La spectroscopie Raman
 Plateforme instrumentale Micro/NanoRaman
Plateforme instrumentale Micro/NanoRaman
Equipement
|
Savoir-faire
|
Applications
|
Financements et partenaires
|
Projet Européen Marie Curie CIG, DIM nanoK (Région île de France), LabEx Michem et Matisse. Partenaires : IMPMC, LCMCP, Monaris, IPCM, LRS, Itodys, LEM |
Contact plateforme
|
Laboratoire LISE (UPMC) – Sous-sol Tour 14-24 - SS05 - 01 44 27 50 70 ivan.lucas@upmc.fr / emmanuel.maisonhaute@upmc.fr / suzanne.joiret@upmc.fr |
I- La spectroscopie Raman
La spectroscopie Raman est une méthode d’analyse chimique non invasive. C’est une spectroscopie vibrationnelle à l’instar de la spectroscopie infrarouge (IR) qui fournit une caractérisation simultanée de la composition chimique d'un matériau, de son environnement ou encore de son degré d'oxydation.
Principe :
|
La spectroscopie Raman est une spectroscopie de diffusion et non d’absorption contrairement à l’IR. Les photons Raman sont émis lors de l’illumination d’un échantillon par une source laser (UV-visible-IR) par le biais d’un phénomène de diffusion inélastique de la lumière. Le gain ou la perte d’énergie des photons inélastiques émis par rapport aux photons incidents est traduit sur les spectres Raman par un déplacement en fréquence (Raman shift). Les bandes Raman observées à un déplacement en fréquence donné (u0 - uinelast) correspond à l’écart en énergie entre les niveaux vibrationnels de la molécule analysée. |
Avantages :
|
Limitations :
|
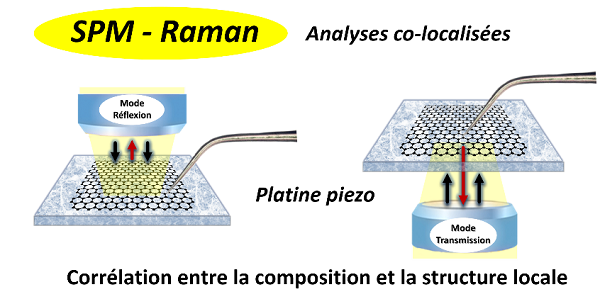
II- Les mesures co-localisées SPM/Raman
|
La microscopie SPM permet d'obtenir la topographie de l'échantillon, mais aussi de nombreuses autres informations : propriétés mécaniques, électriques, etc. Dans cette nouvelle configuration couplée SPM/Raman, la cartographie de composition par microspectroscopie Raman peut être effectuée en routine exactement à l'endroit où ont été réalisées les mesures AFM/STM mais reste limitée en résolution par la diffraction (~l/2). Ces mesures couplées peuvent être mis en œuvre lorsque les matériaux sont en conditions opératoires, électrochimiques par exemple. |
III- La spectroscopie Raman exaltée
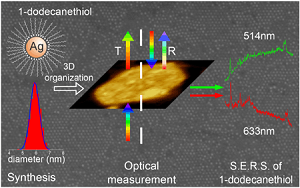
La faible sensibilité de la spectroscopie Raman a été compensée par l’introduction de la spectroscopie Raman exalté de surface (SERS). Cette méthodologie repose sur l’utilisation de substrats présentant des nanostructurations ou bien décorés de nanoparticules d’or ou d’argent (SHINERS). Les électrons libres du métal oscillent à la surface de ces nanostructures à la résonance plasmon (Localized Surface Plasmon Resonance: LSPR), donnant lieu à une forte amplification localisée du signal Raman de composés à proximité, jusqu’à 1010, permettant la détection de molécules uniques.

→ Le LISE dispose des savoir-faire pour mettre au point les substrats SERS : a) dépôt d’or sur mica, b) assemblage supramoléculaire de nanoparticules d’or ou d’argent (collaboration avec Alexa Courty : Monaris), c) synthèse de particules SHIN cœur (or et d’argent) / coquille (silice), d) sonde TERS ou SERS à point chaud unique.
La spectroscopie Raman exaltée de pointe (TERS)
Pour obtenir une signature spectrale à une échelle plus fine que le micromètre (de l'ordre de quelques nanomètres à l'heure actuelle), il faut que la source de l'excitation Raman soit elle-même nanométrique. Cette méthodologie récente exploite l'amplification du champ électromagnétique et donc du signal Raman observée au niveau de nanoantennes (par effet de pointe), c’est l’effet TERS. Cette nouvelle méthodologie proposée pour la première fois dans les années 2000 est délicate à mettre en œuvre et reste l’apanage de quelques laboratoires spécialisés.
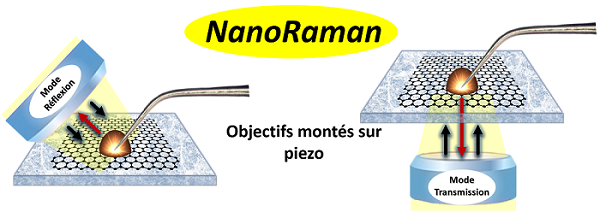
Quelques définitions:
|
Champ proche et champ lointain : A la différence du SERS, les mesures TERS utilisent une pointe effilée (or, argent) illuminée par une source laser et amenée au contact de l’échantillon à analyser. Grâce au confinement du champ électrique à l’extrémité de la pointe (point chaud), le signal Raman des composés à la jonction pointe/substrat (signal champ proche optique) est considérablement amplifié. Le signal sous pointe domine largement le signal microRaman provenant de la surface illuminée de l’échantillon (signal champ lointain), permettant l’extraction de signature chimique à l’échelle nanométrique. Gap-mode TERS : Une sensibilité et résolution spatiale accrues peuvent être obtenues dans la configuration gap-mode TERS pour laquelle le composé à analyser est sandwiché entre la pointe et une surface d’or ou d’argent. Point chaud : alors que le signal SERS peut provenir de plusieurs points chauds simultanément, the point chaud unique développé à l’extrémité de la pointe qui est très limité spatialement, doit être soigneusement identifié et localisé. La focalisation précise du laser d’excitation à l’extrémité de la pointe et la recherche du point chaud sont obtenues en utilisant des objectifs à fort grossissement et à grande ouverture numérique montés sur des platines piézoélectriques (déplacement 30 x 30 µm). Source laser polarisées: pour induire la LSPR au niveau des sondes TERS, des sources laser polarisées sont utilisées et la composante principale du champ électrique alignée selon l’axe de la pointe. Pour les échantillons opaques, une source lumineuse polarisée linéairement est focalisée à l’extrémité de la pointe au travers de l’objectif positionné soit sur le côté de la pointe ou sur le dessus (pointe trompe d’éléphant). Pour les échantillons transparents déposés sur des lames de microscope, l’extrémité de la pointe peut être illuminée par-dessous au travers de l’échantillon en utilisant une source laser polarisée radialement. |
Sondes TERS - Si les instruments permettant un couplage optique robuste nécessaire aux mesures TERS sont apparus sur le marché des microscopies, le frein principale au développement du TERS a été et reste la difficulté à concevoir des sondes TERS aux propriétés contrôlées. L’angle d’ouverture, le rayon de courbure, la stabilité chimique (oxidation de l’argent) et mécanique sont autant de paramètres qui conditionnent l’apparition et le maintien dans le temps d’une résonance plasmon effective à l’extrémité de la pointe pour une longueur d’onde d’excitation donnée, conditions nécessaires pour une exaltation forte et reproductible du signal Raman. Le LISE dispose des savoir-faire pour mettre au point les sondes TERS (dissolution électrochimique de fil d’or et d’argent).
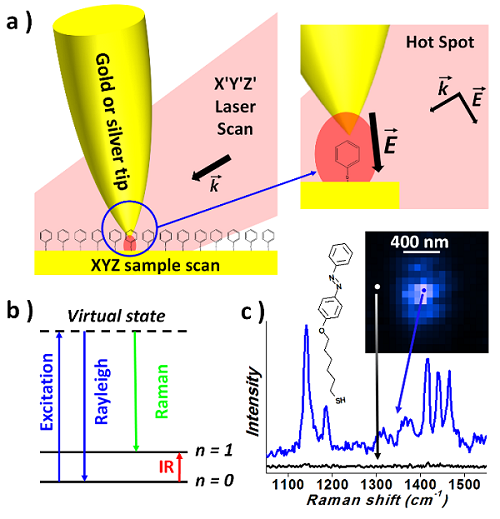
Principe du TERS: a) un laser d'excitation laser est focalisé à l'extrémité d'une pointe métallique (or/argent pour une excitation visible) créant une amplification considérable du champ électromagnétique local à la jonction pointe/échantillon et donc du signal diffusé Raman sous la pointe qui domine le signal provenant de la surface éclairée par le laser, b) la différence d'énergie entre les photons diffusés Raman (diffusion inélastique) et les photons incidents correspond à la différence d'énergie entre les niveaux vibrationnels de la molécule (u0 – u1), de façon similaire à la spectroscopie IR, c) la signature Raman d'une couche moléculaire peut être obtenue à condition de positionner très précisément le laser sur l'extrémité de la pointe, à l'endroit exact du point chaud, grâce à un objectif monté sur une platine piézo.
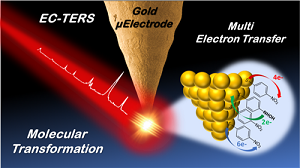
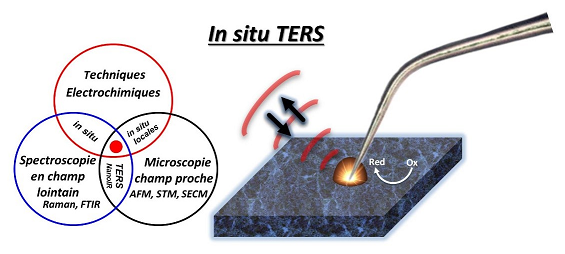
IV- Implémentation en milieu électrochimique : EC-TERS
Notre culture en électrochimie nous a poussés naturellement à étendre les possibilités de l'appareillage vers des mesures en milieu liquide conducteur permettant d'effectuer des analyses en courant en parallèle des mesures spectroscopiques et topographiques. Si les mesures EC-SERS sont déjà bien développées, la méthodologie TERS n'a été jusqu'à présent que très peu mise en œuvre en milieu liquide et en condition électrochimique. La raison principale réside dans la difficulté à collecter efficacement la lumière. Le LISE s’est d’ores et déjà placé parmi les leaders du domaine (R. Van Dyune : Etats-Unis, B. Ren : Chine, K. Domke : Allemagne) en publiant en 2016 les premières cartographies TERS en milieu liquide organique et depuis 2017 en proposant une configuration EC-TERS robuste (travaux de thèse de Thomas Touzalin).
V- L’impédance Raman
En couplant la spectroscopie Raman et spectroscopie d’impédance électrochimique, notamment la modulation de double couche électrochimique, il est possible d’étudier la dynamique d’adsorption de molécules sur une électrode. Il est de plus possible de déterminer le changement d’orientation de ces molécules sur la surface de l’électrode en fonction du potentiel appliqué et d’étudier les variations de capacité de double couche associées.
https://hal.inria.fr/tel-01091322/document
Travaux récents réalisés au LISE:
Optical response and SERS properties of individual large scale supracrystals made of small silver nanocrystals: https://link.springer.com/article/10.1007/s12274-014-0650-5
Tip enhanced Raman spectroscopy imaging of opaque samples in organic liquid: http://pubs.rsc.org/en/content/articlelanding/2016/cp/c6cp02596j#!divAbstract
Complex Electron Transfer Pathway at a Microelectrode Captured by in situ Nanospectroscopy: http://pubs.acs.org/doi/abs/10.1021/acs.analchem.7b01542